通過(guò)RP-HPLC分析和純化蛋白以及多肽
賀文君
RP-HPLC在蛋白質(zhì)研究中占據(jù)了非常重要的位置,用途廣泛,,檢測(cè)的靈敏度高以及可以串聯(lián)質(zhì)譜,,可以用于分離結(jié)構(gòu)非常相似的蛋白以及多肽類(lèi)成分.
蛋白以及多肽在反相中的分離機(jī)制主要是吸附和解吸附的一個(gè)過(guò)程。
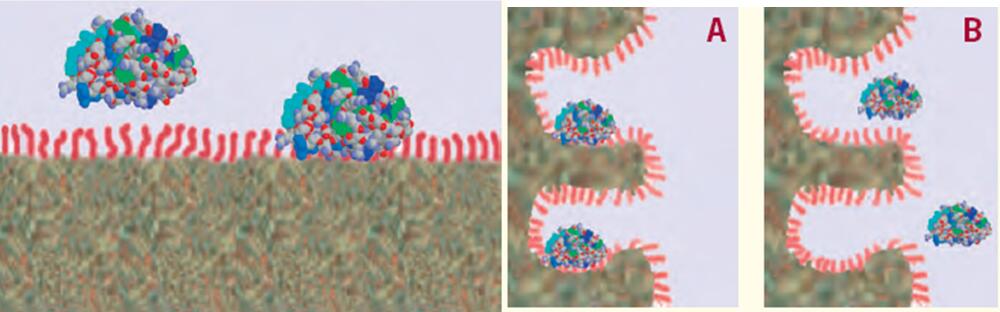
在反相HPLC中,,顆粒表面是十分疏水的,,通過(guò)疏水表面對(duì)蛋白質(zhì)的一面(被稱(chēng)為“疏水足”)吸附,蛋白質(zhì)被保留下來(lái),。
與疏水表面的厚度相比,,蛋白質(zhì)要大得多,,因此蛋白質(zhì)僅有一部分被疏水表面所吸附。
大部分蛋白質(zhì)位于表面上方與流動(dòng)相接觸(蛋白質(zhì)的大部分是在疏水面之上與流動(dòng)相接觸),。
由這種疏水性吸附所導(dǎo)致的凈相互作用非常強(qiáng),,會(huì)導(dǎo)致蛋白質(zhì)保持吸附在表面上直至接觸到特定濃度的有機(jī)溶劑,這時(shí)蛋白質(zhì)會(huì)從表面上解吸附并從色譜柱上洗脫
色譜柱的考量:
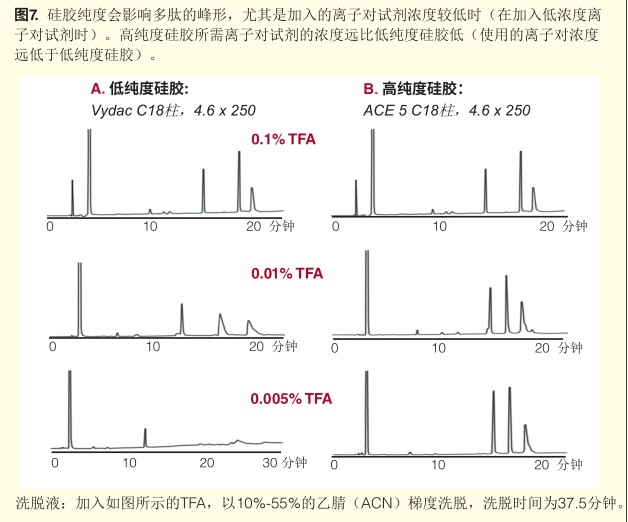
1,,超純超惰性硅膠對(duì)于蛋白多肽化合物的峰形至關(guān)重要,。硅膠的純度,高純度的硅膠在多肽以及蛋白的分析中,,即便在非常低濃度的離子對(duì)試劑中都能獲得極佳的峰形和分辨率,。
超惰性硅膠柱往往需要極少量TFA也可獲得不錯(cuò)的峰形,這點(diǎn)對(duì)LC-MS很有利,。
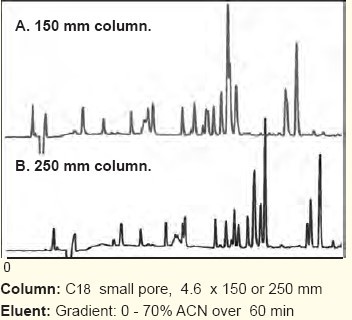
2,色譜柱的長(zhǎng)度方面,,色譜柱的長(zhǎng)度對(duì)于多肽分離而言不是一個(gè)重要的影響參數(shù),,色譜柱的長(zhǎng)度對(duì)于多肽以及蛋白水解產(chǎn)物會(huì)有更大的影響。
為減小分析時(shí)間,,短柱可以做為首先考慮,。對(duì)蛋白分析而言,因?yàn)橄疵摍C(jī)理的原因,,長(zhǎng)短柱對(duì)分離度并不會(huì)有什么明顯影響,,這點(diǎn)和化學(xué)小分子完全不同。
但是對(duì)于小分子多肽,,往往長(zhǎng)柱比短柱的分離度大,,這點(diǎn)類(lèi)似化學(xué)小分子。
3,,色譜柱的內(nèi)徑,,標(biāo)準(zhǔn)的HPLC色譜柱的內(nèi)徑一般是 4.6mm. 相對(duì)于標(biāo)準(zhǔn)的分析柱內(nèi)徑而言,窄的內(nèi)徑會(huì)有更高的靈敏度,。
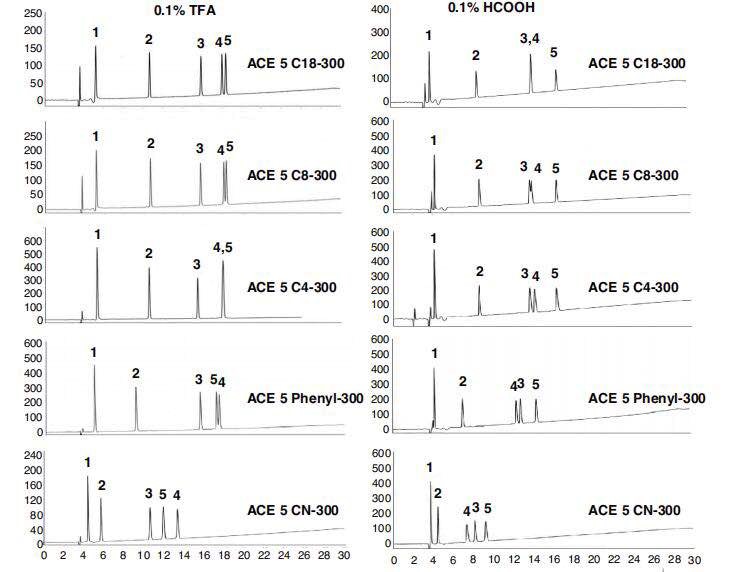
4,,對(duì)于色譜柱固定相的選擇方面,ACT公司推出了生物分析方法開(kāi)發(fā)包,,主要提供三種固定相,,C18-300, C4-300,Phenyl-300,提供三種不同的分離選擇性作為主流用柱,。

![]()
另外,,對(duì)于大分子蛋白的反相用柱選擇還有C8-300, CN-300作為補(bǔ)充選擇用柱。
流動(dòng)相的考量:
1,,有機(jī)相的選擇:
乙腈:廣泛用于反相色譜中分析聚合多肽,。易揮發(fā)且洗脫能力強(qiáng)低的粘度和低的背壓比較透明,,所以紫外吸收弱有很長(zhǎng)的使用歷史。
異丙醇:很少用作單獨(dú)的流動(dòng)相,,因?yàn)檎扯缺容^高,。主要作為一種添加劑,一般添加濃度為1~5%,,用于洗脫強(qiáng)疏水性的蛋白或多肽,。
其他的流動(dòng)相:甲醇或乙醇很少用于疏水性的蛋白質(zhì)分析,由于乙醇的低毒性,,常用于純化蛋白質(zhì),。
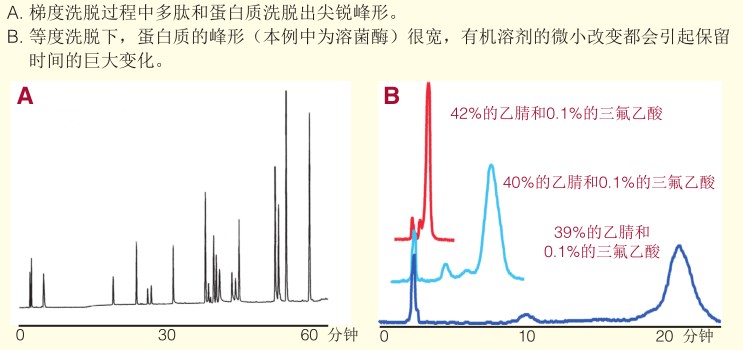
2,梯度洗脫:一般情況下,,梯度變化的越慢,,分辨率越高。
在分析時(shí)間變化不大的前提下,,通過(guò)調(diào)節(jié)梯度變化來(lái)優(yōu)化條件是非常有意義的,,但是也有相反的情況。
在RP-HPLC中,,蛋白和多肽的保留和一般的小分子化合物有所不同,,等度洗脫對(duì)于蛋白質(zhì)的分離作用很小,有機(jī)相比例小的變化會(huì)引起蛋白質(zhì)保留的大的變化,。
3,,離子對(duì)試劑,在PR-HPLC分析蛋白或者多肽的過(guò)程中,,為了獲得更好的峰形,,通常會(huì)在流動(dòng)相中加入一些離子對(duì)試劑。
三氟乙酸:使用最廣泛,,在分析得到的峰形相似的情況下,,硅膠純度越高,使用的離子對(duì)試劑濃度可以相對(duì)更低,。
其他可供選擇的離子對(duì)試劑:磷酸和七氟丁酸也會(huì)用于蛋白和多肽的分離,。
4,pH對(duì)多肽保留的影響:在反相色譜中,, 多肽的分離一般在酸性環(huán)境下進(jìn)行,。
在低的pH值條件下,多肽中的端基羧基以及側(cè)鏈的天冬氨酸和谷氨酸會(huì)質(zhì)子化,,從而增強(qiáng)保留,。
反之,在堿性或中性條件下,會(huì)離子化,,疏水作用降低,,保留減弱。
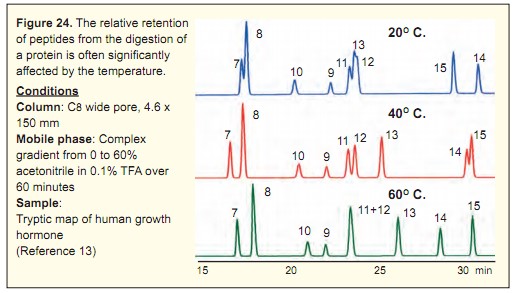
溫度的影響:
柱溫以及流動(dòng)相的溫度從兩方面影響多肽的分離:
溫度升高,,保留時(shí)間會(huì)有一定程度的降低,;
溫度升高會(huì)對(duì)多肽分離的選擇性有一定程度的影響,因此選擇適當(dāng)?shù)臏囟?,?duì)多肽分離,,尤其是肽圖分析顯得尤為重要。