引言
反相HPLC已成為分離和分析蛋白質和多肽的重要工具,。
它在生物技術行業(yè)中被廣泛應用于蛋白質類治療產品的表征,,以及這些產品和雜質的鑒定,。
在通過質譜鑒定蛋白質之前,反相HPLC在從消化后的蛋白質組中分離多肽方面有著至關重要的作用,。
它也被用于探索性研究中多種蛋白質和多肽的純化,,以及蛋白類治療藥物的大規(guī)模純化。
反相HPLC靈敏,、通用性強,還可與質譜等技術結合使用,,在蛋白質研究中具有重要的地位,。
此外,它還能夠分離結構近乎相同的蛋白質,,因而得到了廣泛的應用,。
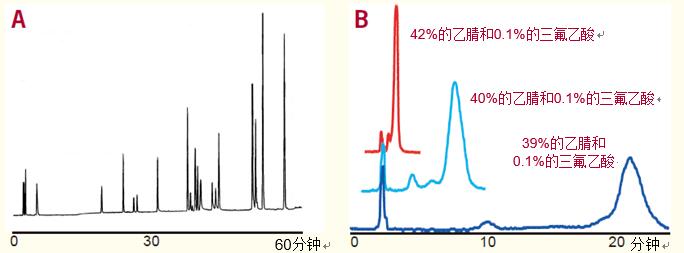
正如牛、人和豬胰島素變異體的分離過程所示(圖1),,反相HPLC能夠分離非常相似的蛋白質,。
牛胰島素和人胰島素僅有三個氨基酸的差別,也能夠被完全分離開來,。
牛胰島素在胰島素“a”鏈的第8位為丙氨酸,,第10位為纈氨酸,,“b”鏈的第30位為丙氨酸。
而人胰島素在胰島素“a”鏈的第8位為蘇氨酸,,第10位為異亮氨酸,,“b”鏈的第30位為蘇氨酸。
圖1. 以RP-HPLC對緊密關聯(lián)的胰島素變異體進行分離
|
條件 色譜柱:ACE 5 C18,4.6 x 250mm 洗脫液:含有29.3 - 31.7% 乙腈的 0.1% 三氟乙酸溶液,,以1.0毫升/分鐘的速率洗脫至少16分鐘 樣品:牛,、人和豬胰島素 |
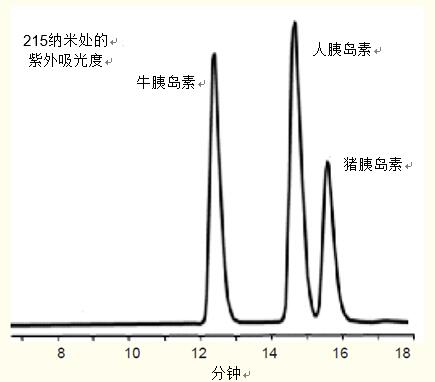 |
豬胰島素和人胰島素僅有一個氨基酸的差異(豬胰島素的“b”鏈第30位為丙氨酸,人胰島素該位置為蘇氨酸),,在基線即已分離,。
在另一個實例中,盡管兔胰島素和人胰島素僅有一個氨基酸的差異,,即以蘇氨酸取代了絲氨酸,,但也同樣得到了分離(參考文獻1)。
反相HPLC的高分離能力也被擴展應用到了多肽上,。
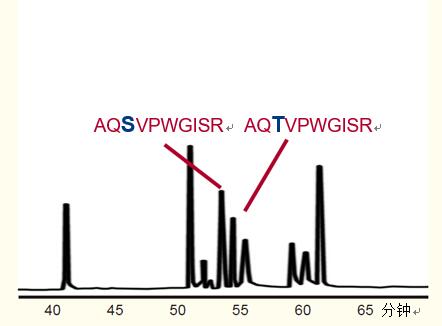
在圖2中,,兩種多肽盡管只有一個氨基酸的差異,即絲氨酸對蘇氨酸,,但也得到了完全的分離,。
這種高分離能力是反相HPLC在蛋白質和多肽分離中得到廣泛應用的基礎性因素。
圖2. 以RP-HPLC對緊密關聯(lián)的多肽進行分離,。僅有一個氨基酸不同的兩種十肽菌素,,一種含絲氨酸,而另一種含蘇氨酸,。
|
條件
色譜柱:C18 寬孔柱,, 4.6 x 250 毫米
洗脫液:
A. 含有0.1%三氟乙酸的水溶液
B. 含有0.08%三氟乙酸的乙腈溶液
梯度:0 - 35%的B溶液超過73分鐘(參考文獻2) |
 |
蛋白質/多肽的保留機制
在反相HPLC中,顆粒表面是十分疏水的,,因為其表面通過化學連接有羥基(圖3中的波浪形紅線),。
通過疏水表面對蛋白質一面(被稱為“疏水性足”)的吸附,蛋白質被保留下來(圖3),。
與疏水表面的厚度相比,,蛋白質要大得多,因此蛋白質僅有一部分被疏水表面所吸附,。
大部分蛋白質位于表面上方并與流動相接觸,。
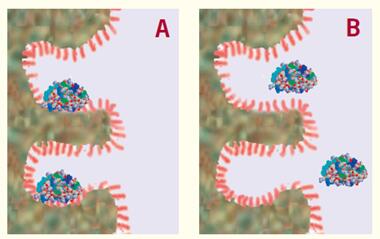
由這種疏水性吸附所導致的凈相互作用非常強,會導致蛋白質保持吸附在表面上(圖4A),,直至接觸到特定濃度的有機溶劑,,這時蛋白質會從表面上解吸附并從色譜柱上洗脫(圖4B)。
在最初的吸附/解吸附之后,,盡管蛋白質在從色譜柱上移動下來時仍會與表面產生一些相互作用,,但卻是十分微弱的,,對分離過程無影響。
分離是由單次吸附/解吸附過程完成的,。
解吸蛋白質所需要的有機改性劑的濃度十分精確,,并與疏水足的大小呈函數關系。
詳情請參閱參考文獻3,。
圖4. 進入色譜柱的蛋白質被吸附在柱頂端附近的疏水表面上(A)并且一直保持吸附,,直至有機改性劑的濃度達到特定值,此時蛋白質從表面解吸附(B),。
在反相HPLC中,,吸附/解吸保留機制導致蛋白質的保留行為與小分子不同。
小分子的保留行為隨著有機溶劑濃度的改變而緩慢改變時(圖5,,聯(lián)苯),,一旦有機溶劑的濃度達到所需要的值,蛋白質的保留行為即發(fā)生突然改變,,引起保留時間的快速變化(圖5,,蛋白質)。
該過程產生的尖銳峰形常見于蛋白質和多肽(圖6A),。
由于有機溶劑濃度的微小變化會引起的顯著的保留行為變化,,等度洗脫很少被用于蛋白質中,因為峰變寬了,,而有機溶劑的微小改變會導致蛋白質保留行為的巨大變化(圖6B),。
圖5.有機溶劑濃度對應的保留行為
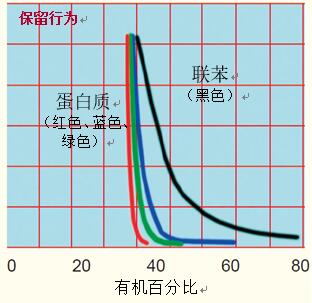
圖6.
A. 梯度洗脫過程中多肽和蛋白質洗脫出尖銳峰形。
B. 等度洗脫下,,蛋白質的峰形(本例中為溶菌酶)很寬,,有機溶劑的微小改變都會引起保留時間的巨大變化。