反相高效液相色譜和質(zhì)譜(MS)的聯(lián)用為蛋白質(zhì)/多肽分析提供了強(qiáng)大的工具。
20世紀(jì)80年代,,約翰·貝內(nèi)特·芬恩和他的同事們開(kāi)發(fā)了電噴霧離子源,,使質(zhì)譜與反相高效液相色譜得以聯(lián)用,。
采用液相色譜-質(zhì)譜聯(lián)用的好處包括:
-
質(zhì)譜是非常靈敏的檢測(cè)技術(shù),。
-
質(zhì)譜可以提供所分離多肽/蛋白質(zhì)的分子量,。
-
質(zhì)譜可利用分子量特異性檢測(cè)蛋白質(zhì),。
-
片段信息有助于確認(rèn)多肽,。
-
質(zhì)譜基于電荷和質(zhì)量進(jìn)行分離和測(cè)定,,因此,,與基于疏水性分離的反相色譜“正交”。
高效液相色譜-質(zhì)譜聯(lián)用廣泛用于肽圖的分析,,提供了一種正交檢測(cè)肽法(參考文獻(xiàn)15),。
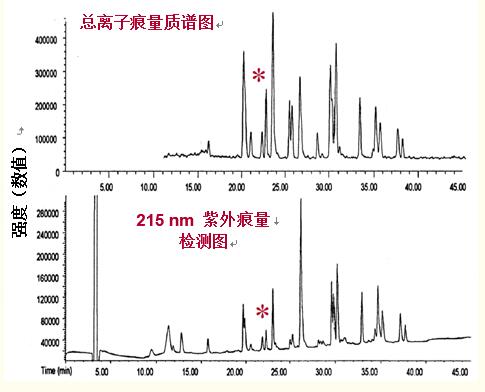
如圖26所示,總離子質(zhì)量色譜圖與紫外色譜圖相似,,但由于正交檢測(cè)的使用,,峰的大小不同,。
事實(shí)上,采用紫外檢測(cè)出現(xiàn)的小峰在質(zhì)譜圖中會(huì)更明顯(見(jiàn)圖26“*”),。
圖26. 肽圖的分離可以通過(guò)紫外檢測(cè)和質(zhì)譜檢測(cè)來(lái)監(jiān)測(cè),。
峰高是檢測(cè)法的一個(gè)函數(shù),在紫外圖譜和質(zhì)譜圖譜間有明顯不同,。
特別是用“*”標(biāo)示的肽對(duì),。它們?cè)?/span>UV檢測(cè)圖譜中顯示的峰值較小,但在質(zhì)譜圖中峰值較大,。
通過(guò)測(cè)定每個(gè)峰中肽的分子量,,質(zhì)譜分析法為識(shí)別RP-HPLC法分離的峰提供了有用的信息。
由于質(zhì)譜與反相高效液相色譜正交,,因此質(zhì)譜還能確定峰純度或顯示兩種或兩種以上肽的共洗脫,,并能提供肽的分子量。
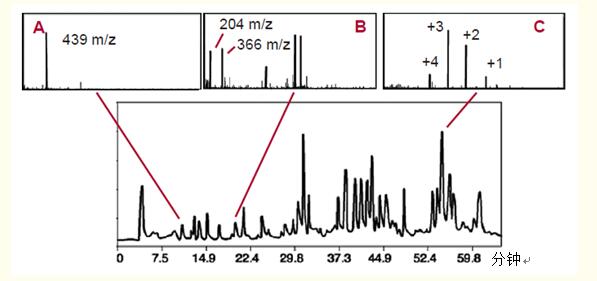
圖27以肽圖中的三個(gè)峰值展示了這一點(diǎn),。A峰較早洗脫出來(lái),,是分子量為439道爾頓的四肽。B峰是一種糖肽,,有寡糖或多聚糖吸附,。
通過(guò)質(zhì)譜圖中B峰存在質(zhì)荷比為204和366兩種離子確定,這表明存在糖基化反應(yīng),。
C峰是一種二硫化物連接的二肽——由二硫鍵連接的兩個(gè)多肽,。
顯示該肽有四種離子形式:+1、+2,、+3和+4,。只有含兩個(gè)氨基末端和兩個(gè)堿性氨基酸的二肽才會(huì)出現(xiàn)+4離子。
圖27. 反相色譜強(qiáng)大的分離能力與第二個(gè)維度的質(zhì)譜的結(jié)合為肽圖提供了大量的信息,。
A. MS確認(rèn)A峰代表小分子肽,。
B. 檢測(cè)到的B峰代表含多聚糖(糖)的肽。
C. C峰代表一種二肽——由二硫鍵連接的兩個(gè)肽,。
HPLC-MS
聯(lián)用的兩個(gè)重要因素是電噴射接口的最佳流速及三氟乙酸對(duì)肽電離的影響
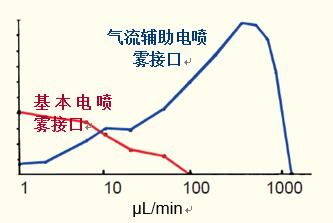
基本電噴霧接口的信號(hào)在5~10μL/min的流速區(qū)間上迅速下降(圖28),。
這與采用標(biāo)準(zhǔn)分析型HPLC柱的流速不相容。
目前,,商用電噴霧提供一種高剪切流氮?dú)廨o助的電噴霧(氣流輔助電噴霧),,它將電噴霧的最佳流速區(qū)間提升到了200~500μL/min。
這仍然低于標(biāo)準(zhǔn)分析柱通常所用的最佳流速,,因此,,目前科學(xué)家在使用HPLC-MS時(shí),普遍采用流速為200~300μL/min的細(xì)孔柱(內(nèi)徑~2 mm)
圖28. 紅線表示基本電噴霧接口流速與信號(hào)響應(yīng)的關(guān)系。藍(lán)線同樣表示氣流輔助電噴霧的信號(hào)響應(yīng),。
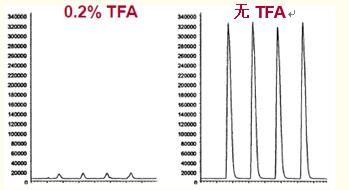
如圖29所示,,流動(dòng)相中的TFA流入電噴霧接口導(dǎo)致蛋白質(zhì)和多肽的信號(hào)減弱。
這是由于TFA和多肽間強(qiáng)烈的相互作用將多肽中和,。
圖29. 使用電噴霧接口時(shí),,TFA的流入會(huì)大幅減弱多肽的信號(hào)。
有兩種方法可糾正由TFA引起的信號(hào)減弱:
-
忽略信號(hào)損失,。通常,,當(dāng)信號(hào)足夠強(qiáng)大時(shí),即使信號(hào)減弱也仍能獲得有用的數(shù)據(jù),。在這種情況下可以忽略信號(hào)損失,。
-
當(dāng)信號(hào)損失過(guò)多時(shí),最佳的解決方案是將高純度硅膠柱與低濃度TFA結(jié)合使用,。
高純度硅膠柱與低濃度TFA一同使用仍能維持較好的峰形(圖30),。
采用高純度硅膠柱能得到良好的信號(hào)響應(yīng)和峰形。
其它方案包括用甲酸代替TFA或柱后采用乙酸或丙酸代替TFA,。
但采用甲酸得到的峰形不如TFA,,分離度也不如TFA,因此會(huì)影響性能,。
這在蛋白質(zhì)組學(xué)應(yīng)用中可以接受,,但在蛋白質(zhì)治療藥物中不可行。
柱后替換TFA較為棘手,,且會(huì)導(dǎo)致分辨率下降,。
圖30. 高純度硅膠與低濃度TFA一同使用,保持肽的峰形,。
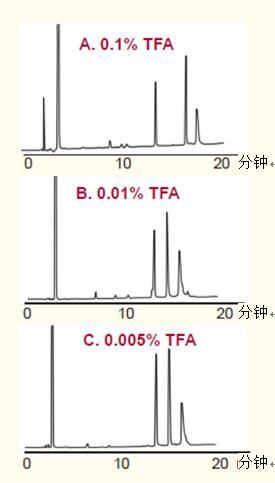
色譜柱:ACE 5 C18, 4.6 x 250 mm(高純度硅膠)
洗脫液:加入如圖所示的TFA,,以10%-55%的乙腈(ACN)梯度洗脫,洗脫時(shí)間為37.5分鐘,。



