肽圖分析法 - 蛋白質(zhì)和多肽反相HPLC分析和純化指南
反相高效液相色譜已成為蛋白質(zhì)分析和表征的標(biāo)準(zhǔn)方法,,尤其是治療性藥物的分析和表征,。
反相色譜分析法分辨率高,,檢測(cè)靈敏度好,,能夠提供大量關(guān)于蛋白質(zhì)的信息。
有些時(shí)候,,蛋白質(zhì)作為完整的分子分析,,但更多的時(shí)候采用蛋白水解酶作用于特殊的氨基酸殘基將碳骨架斷開(kāi),從而將蛋白質(zhì)裂解成小片段,。
隨后用反相高效液相色譜法對(duì)裂解產(chǎn)生的肽段進(jìn)行分析,。
該技術(shù)叫作肽圖分析,是一種標(biāo)準(zhǔn)的蛋白質(zhì)分析方法,。
通過(guò)反相色譜分析蛋白質(zhì)裂解后的肽段能夠獲得蛋白質(zhì)的大量信息,。
通過(guò)比較表達(dá)蛋白與參照標(biāo)準(zhǔn)蛋白的肽圖能夠得出蛋白純度和表達(dá)的準(zhǔn)確性。肽圖通常作為蛋白質(zhì)治療藥物的鑒定分析工具,。
-
通過(guò)肽圖可以確定蛋白質(zhì)降解產(chǎn)物,,如發(fā)生脫酰胺作用的天冬酰胺和氧化甲硫氨酸。
-
肽圖可以確認(rèn)或驗(yàn)證二硫鍵連接,,以此得出蛋白質(zhì)三級(jí)結(jié)構(gòu)和療效,。
-
肽圖能夠確定糖基化(加入碳水化合物)位點(diǎn),為詳細(xì)鑒定連接在其上的寡糖提供了條件,。
-
利用質(zhì)譜檢測(cè)得到的肽圖為蛋白質(zhì)鑒定,、肽序列分析和數(shù)據(jù)確認(rèn)提供了一種先進(jìn)的手段。
在生物蛋白質(zhì)組研究中,,蛋白酶水解產(chǎn)物還用于蛋白質(zhì)的鑒定和定量分析,。
有許多蛋白水解酶都能斷開(kāi)蛋白質(zhì)的碳骨架,通常作用于特殊氨基酸殘基,。包括:
|
蛋白酶 |
特異性 |
特性 |
|
胰蛋白酶 |
作用于賴氨酸和精氨酸的羧基端 |
平均每10~12個(gè)氨基酸產(chǎn)生一個(gè)肽,。胰蛋白酶是最常用的蛋白水解酶。 |
|
胞內(nèi)蛋白酶 Lys-C |
作用于賴氨酸的羧基端 |
能夠產(chǎn)生胰蛋白酶水解蛋白生成多肽的60~70%,。Lys-C 的優(yōu)點(diǎn)是在高達(dá)4M的尿素濃度中仍能保持活性,。 |
|
S. aureus V8 蛋白酶 |
作用于酸性氨基酸和天冬氨酸的羧基端。 |
為胰蛋白酶水解法提供補(bǔ)充信息。 |
|
胞內(nèi)蛋白酶 Asp-N |
作用于天冬氨酸的羧基端 |
為胰蛋白酶水解法提供補(bǔ)充信息,。 |
胰蛋白酶是最常用的蛋白水解酶(蛋白酶),。以下為胰蛋白酶水解蛋白的五個(gè)階段:(注:參考文獻(xiàn)21詳細(xì)回顧了胰蛋白酶的水解)
-
變性。要在合理的時(shí)間內(nèi)完成蛋白質(zhì)水解,,必須對(duì)蛋白質(zhì)作變性處理,。高溫下(37℃),將蛋白質(zhì)置于6M 鹽酸胍或8M 尿素等離液劑中,,在中性pH值(~7.5)緩沖液下處理30分鐘,,蛋白質(zhì)即可變性。
-
二硫鍵的還原,。二硫鍵會(huì)阻止蛋白質(zhì)的完全變性。
通??赏ㄟ^(guò)在待水解蛋白的變性過(guò)程中加入濃度為~20 mM 的二硫蘇糖醇(DTT)等還原劑將二硫鍵還原,。 -
游離半胱氨酸的羧甲基化,。如果還原性半胱氨酸保持游離狀態(tài),則有可能以錯(cuò)誤的方式重新形成二硫鍵,。
為了避免這種情況,,可加入濃度為~60mM的碘乙酸等試劑,在37℃溫度下處理30分鐘,,使游離半胱氨酸甲基化,。該反應(yīng)由100 mM DTT 退火,。 -
脫鹽。當(dāng)溶液中存在尿素或胍鹽時(shí),,水解反應(yīng)無(wú)法進(jìn)行,因?yàn)橐鹊鞍酌缸陨碜鳛橐环N蛋白質(zhì)會(huì)變性,,失去酶活性,。
尿素或胍鹽必須通過(guò)離子交換或滲析去除或?qū)舛冉档椭?/span>1M以下,。 -
胰蛋白酶水解。脫鹽后,,將蛋白質(zhì)溶解在pH7.5~8.5(胰蛋白酶的最高活性pH)的緩沖液中——Tris或碳酸銨,,并在20~100個(gè)待水解蛋白組分中加入一份胰蛋白酶,隨后在低溫至37℃的溫度區(qū)間內(nèi)處理蛋白質(zhì),。
低溫處理時(shí)間長(zhǎng)達(dá)16個(gè)小時(shí),。在37℃下,水解可在1~4小時(shí)內(nèi)完成,,具體取決于蛋白質(zhì),。
如果胰蛋白酶的時(shí)間、溫度或相對(duì)濃度均過(guò)低,,則水解將不完全,,一些潛在裂解可能不發(fā)生,最終導(dǎo)致形成含賴氨酸或精氨酸的大分子肽,。
如果胰蛋白酶的水解時(shí)間,、溫度或濃度均過(guò)高,,則會(huì)發(fā)生胰蛋白酶自身溶解,產(chǎn)生“自溶產(chǎn)物”,,即胰蛋白酶水解產(chǎn)生的肽段,,從而造成混淆。
慣常的做法是忽略蛋白質(zhì),,考慮胰蛋白酶,。按照蛋白質(zhì)完全水解的條件對(duì)得到的樣品進(jìn)行色譜分析,了解胰蛋白酶自溶的程度以及肽圖中任何胰蛋白酶自溶肽產(chǎn)物的位置,。
開(kāi)發(fā)胰蛋白酶水解協(xié)議過(guò)程中,,對(duì)胰蛋白酶和蛋白質(zhì)的水解時(shí)間、溫度和相對(duì)濃度進(jìn)行了優(yōu)化,。
當(dāng)利用肽圖確定二硫鍵的位置時(shí),,必須在不還原二硫鍵的情況下水解蛋白。但在二硫鍵未被還原的情況下,,許多蛋白質(zhì)的水解速度非常慢,。
在缺還原劑的情況下,如果水解速度很慢或水解不佳,,可利用Lys-C代替胰蛋白酶,,并在4M尿素中水解,維持水解過(guò)程中蛋白質(zhì)的變性,。
水解過(guò)程中有時(shí)采用表面活性劑維持溶液中的蛋白質(zhì),,但表面活性劑會(huì)降低色譜分辨率,應(yīng)盡量避免,。
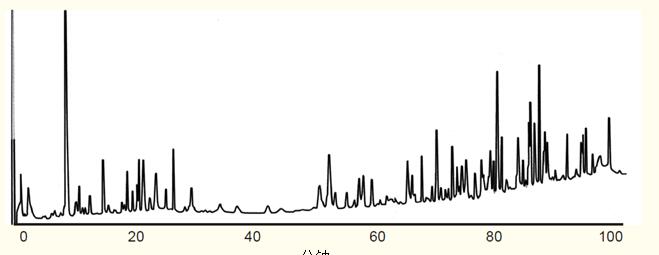
胰蛋白酶水解分析,。蛋白質(zhì)水解產(chǎn)生的肽段利用反相高效液相色譜分析,流動(dòng)相采用含TFA體系(參見(jiàn)第15-17頁(yè)),,以起始濃度約5%的乙腈梯度洗脫(乙腈起始濃度低于5%可能導(dǎo)致較早洗脫出肽的色譜的不可重現(xiàn)性),,乙腈濃度逐漸升至70%(參見(jiàn)圖31)。
梯度洗脫的時(shí)間取決于待水解蛋白的大小,。
大分子蛋白比小分子蛋白水解產(chǎn)生更多的肽段,,因此肽段的分離需要更長(zhǎng)洗脫時(shí)間。
小分子蛋白(小于20kd)水解產(chǎn)生的肽通??稍?/span>45~60分鐘內(nèi)完成分離,。
大分子蛋白(20-50kd)需要較長(zhǎng)的洗脫時(shí)間,一般為60~120分鐘,。
分子量大于50kd的蛋白質(zhì)需要120~180分鐘的洗脫時(shí)間,。
采用1~2 ml/min 的流速和適宜的溫度時(shí)分辨率最佳。
通常采用C18 反相柱,??梢允褂每讖綖?/span>100?;?/span>300埃的柱子,其選擇性通常不同,。
圖31. 牛血清白蛋白的肽圖
色譜柱:ACE 5 C18-300 寬孔柱,,4.6 x 150 mm
流動(dòng)相:4%~70%乙腈-0.1% TFA 體系,混合梯度洗脫120分鐘,。
蛋白質(zhì)修飾引起肽保留時(shí)間的變化,。如果蛋白質(zhì)因翻譯或表達(dá)錯(cuò)誤,降解(脫酰胺作用,、氧化反應(yīng))或過(guò)程變異而改變,,則這種改變將會(huì)反映在一種或多種肽段。
由于與肽的反相相互作用的靈敏度,,肽的任何變化都將導(dǎo)致該肽保留時(shí)間的變化,。
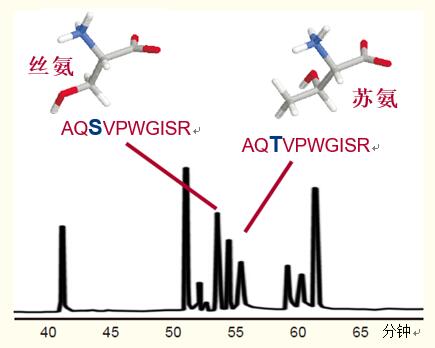
在圖32示例中,相差一個(gè)氨基酸的兩種十肽,,其中一個(gè)為蘇氨酸,,另一個(gè)為絲氨酸,在反相HPLC圖譜中出現(xiàn)了兩個(gè)峰,。
不僅僅是一個(gè)氨基酸的差別,,而且兩種氨基酸均為羥基氨基酸,它們的不同之處在于蘇氨酸側(cè)鏈上加了一個(gè)甲基,。
這說(shuō)明了蛋白質(zhì)的任何變化都會(huì)反映為肽的變化,,從而導(dǎo)致該肽保留時(shí)間的改變。
肽圖分析的本質(zhì)是反相HPLC能夠?qū)崿F(xiàn)差別細(xì)微的多肽的分離,。
圖32. 以RP-HPLC對(duì)緊密關(guān)聯(lián)的肽類進(jìn)行分離。
僅有一個(gè)氨基酸不同的兩種十肽菌素,,一種含絲氨酸,,而另一種含蘇氨酸。
條件
色譜柱:C18 寬孔柱,, 4.6 x 250 毫米
洗脫液:
A. 含有0.1%三氟乙酸的水溶液
B. 含有0.08%三氟乙酸的乙腈溶液
梯度:0 - 35%的B溶液超過(guò)73分鐘
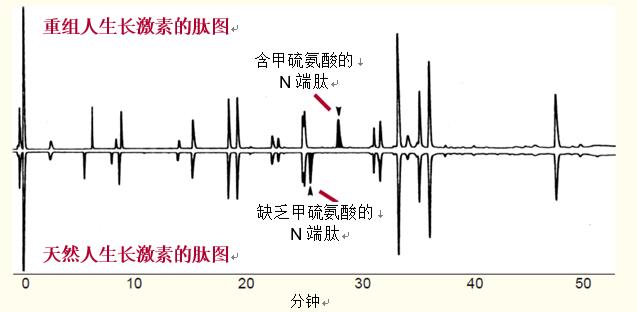
試樣肽圖與參照蛋白質(zhì)肽圖的比較,。肽圖能夠提供有關(guān)蛋白質(zhì)的很多信息。
慣常做法是對(duì)試樣的肽圖和參照蛋白質(zhì)的肽圖進(jìn)行比較,。
圖33對(duì)重組人生長(zhǎng)激素(在大腸桿菌中表達(dá))的肽圖和天然人生長(zhǎng)激素(缺乏甲硫氨酸)的肽圖進(jìn)行了比較,。
由于甲硫氨酸的疏水性質(zhì),重組人生長(zhǎng)激素比天然人生長(zhǎng)激素較晚洗脫出來(lái),。
在這個(gè)例子中,,為了便于比較,將第二幅圖譜倒置顯示,。
在一些情況下,,為了確認(rèn)微小的變化和證明分析工具與肽圖的變化無(wú)關(guān),,會(huì)將兩種水解產(chǎn)物混合進(jìn)行色譜分析。
肽圖比較揭示了蛋白質(zhì)的改變和修飾,,如:基因改變,、翻譯錯(cuò)誤、蛋白降解(脫酰胺作用,、氧化反應(yīng)),,以及翻譯后修飾的改變。
圖33. 重組人生長(zhǎng)激素和天然人生長(zhǎng)激素(缺乏甲硫氨酸)肽圖的比較,。
條件:
色譜柱:C18寬孔柱,,4.6 x 150 mm
流動(dòng)相:0~70% 乙腈-0.1% TFA 體系梯度洗脫